納米材料聯合免疫療法在腫瘤原發瘤及其轉移竈治療方面具有巨大優勢💺。通過納米材料靶向🐀,調節並加強免疫系統級聯反應中的關鍵步驟,如抗原釋放及呈遞🏊🏿♀️、免疫細胞介導的殺傷等,來加強腫瘤免疫循環,最大程度地激活機體免疫系統。同時通過納米材料對腫瘤微環境的調節,克服腫瘤免疫逃逸,從而增加腫瘤的治療效果😰。然而納米材料的生物安全性、腫瘤的靶向性及基於納米材料腫瘤的免疫原性長期激發及免疫逃逸等重要問題的解決🥾,仍然存在巨大的挑戰🦸🏽♂️。基於此👩🏼🎤🫱🏿,意昂4体育平台張春富課題組在納米調節腫瘤免疫方面開展了一系列工作。
課題組首先基於具有獨特生物和光學特性的碳納米角(single-walled carbon nanohorns🕵🏻♂️,SWNHs)載體◀️,構建了負載臨床一線藥物阿黴素和順鉑的腫瘤診療體系。研究發現該體系能同時靶向三陰性乳腺癌原發瘤及其肺部轉移竈▶️,在多模態影像(光聲、熒光、核磁)引導下,實現了雙化療-熱療協同治療。該創新性療法克服原位瘤化療耐藥、熱療腫瘤復發、實現原位瘤治愈的同時,也成功抑製了肺轉移竈[1](Theranostics 2018, 8, 1966)🥛。

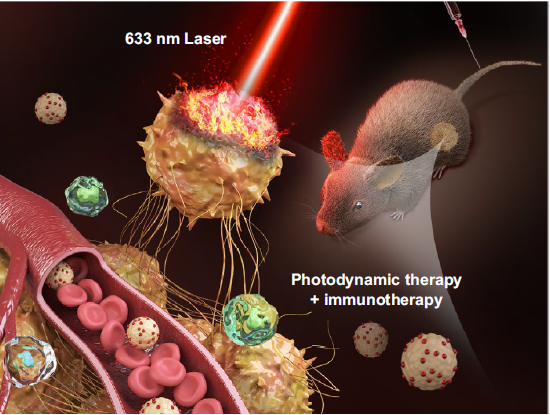
在此基礎上,課題組深入研究了SWNHs介導的精準光免疫治療晚期三陰性乳腺癌轉移的治療效果[2](Advanced Science 2020,2001088)🎳。研究發現原位瘤順序光動力治療(PDT)和光熱治療(PTT)可引發不同類型免疫原性蛋白釋放,而作為免疫佐劑的SWNHs診療系統可捕獲免疫原性物質,並長期、持續地從原位瘤遷移到腫瘤引流淋巴結🏌🏽♀️,從而引起T細胞持久激活,並有效地浸潤到原發腫瘤實質和遠端轉移竈。這種局部精準治療誘發的系統性抗腫瘤免疫反應,打破了臨床批準的免疫療法(腫瘤疫苗、CAR-T和免疫檢查點阻斷)的局限性和免疫耐受性,增強了腫瘤免疫原性🎣、抗原呈遞和T淋巴細胞浸潤,從而實現原發腫瘤和遠處轉移竈同時抑製🏃♂️,而且產生的免疫記憶效應阻止了腫瘤的復發和再次入侵⚒。

為了進一步增強光免疫治療療效🧚,同時減少肝脾部對納米載體的攝取,聯合意昂4平台電子信息與電子工程意昂4崔大祥教授課題組,探索通過誘導多能幹細胞(induced pluripotent stem cells,iPS cells)遞送光動力治療納米系統,創造性地探討iPS幹細胞增強光免疫治療中作用[3](Nano-Micro Letters 2020, 12)。iPS聯合光動力治療,在改變腫瘤微環境乏氧的狀態下🤴,不僅在原位引起強烈的先天性免疫🤕,而且由於光動力治療產生的iPS碎片提供了腫瘤共源性抗原(tumor-shared antigens)👩🏼🔬,增加了DC細胞的遞呈,從而激發強烈的適應性免疫🧚🏿♀️。該納米-免疫系統在降低調節性T細胞(Treg)的前提下,同樣很好的抑製了原發瘤及轉移竈的生長👰🏻♀️。
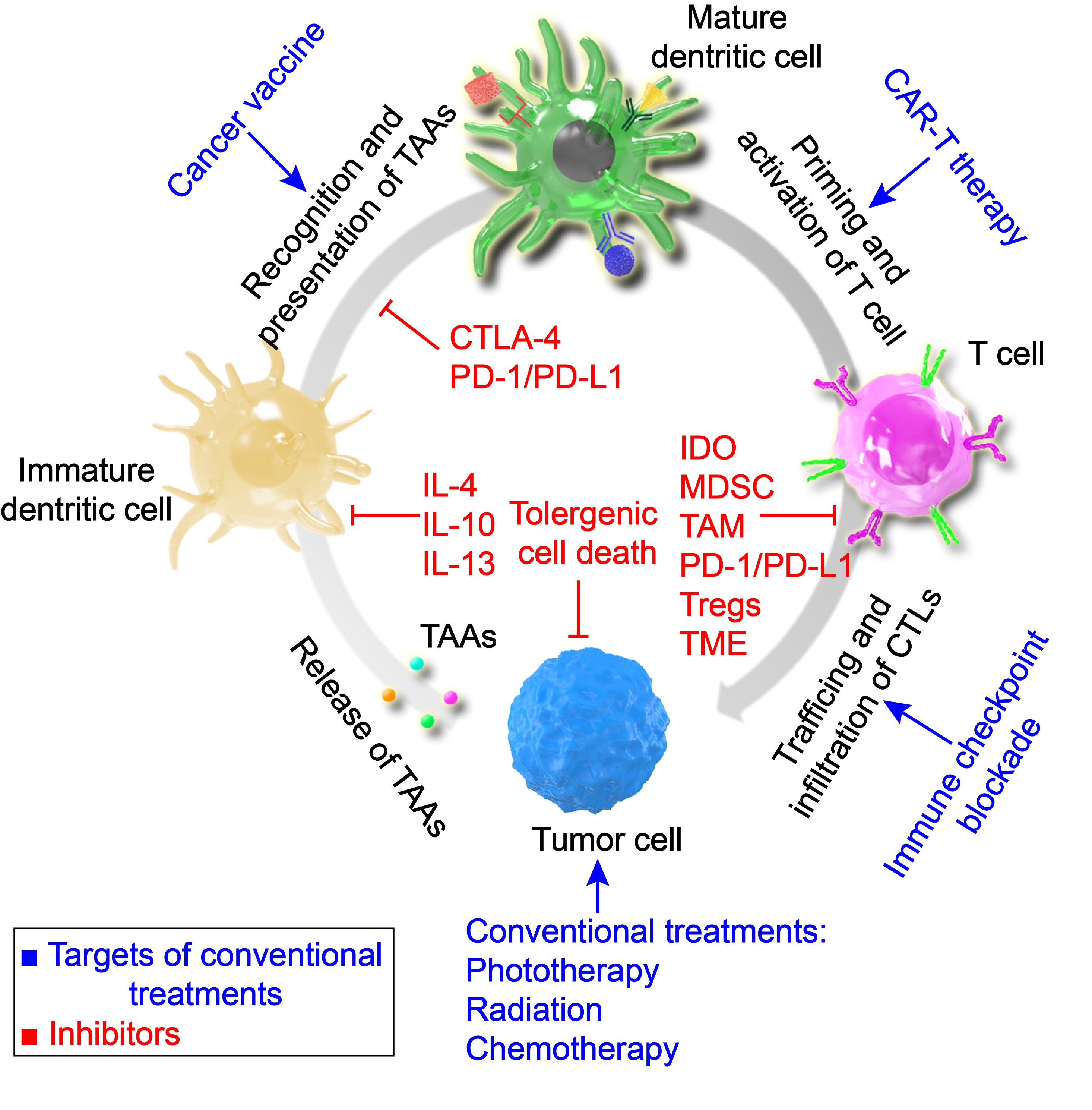
基於以上研究,受WIREs Nanomedicine & Nanobiotechnology雜誌邀請,團隊撰稿系統綜述了納米材料在腫瘤免疫治療中研究進展[4](Wiley Interdiscip Rev Nanomed Nanobiotechnol 2020, 12, e1612)🐱,集中討論了納米材料對天然免疫反應和獲得性免疫反應的有效激活和長期刺激,以及對腫瘤微環境特別是腫瘤免疫抑製微環境的調節或重塑。並且闡述了納米材料在腫瘤免疫循環中的靶點和挑戰,總結了將“冷”腫瘤轉化為“熱”的腫瘤免疫微環境的幾種主要策略。最後,展望了納米聯合免疫治療策略在腫瘤靶向、腫瘤免疫環境正常化和巨噬細胞修飾等方面的應用前景。
參考文獻🦹🏼:
[1] J. Yang, H. Su, W. Sun, J. Cai, S. Liu, Y. Chai, C. Zhang, Theranostics 2018, 8, 1966.
[2] J. Yang, M. Hou, W. Sun, Q. Wu, J. Xu, L. Xiong, Y. Chai, Y. Liu, M. Yu, H. Wang, Z. P. Xu, X. Liang, C. Zhang, Advanced Science 2020, 2001088.
[3] Y. Liu, J. Yang, B. Liu, W. Cao, J. Zhang, Y. Yang, L. Ma, J. M. de la Fuente, J. Song, J. Ni, C. Zhang, D. Cui, Nano-Micro Letters 2020, 12.
[4] J. Yang, C. Zhang, Wiley Interdisciplinary Reviews-Nanomedicine and Nanobiotechnology 2020, 12, e1612.