2019年7月11日🖍,意昂4体育平台李力課題組🎂,醫意昂4附屬仁濟醫院薛婧課題組和孫勇偉課題組🤴🏽,在GUT雜誌上發表了題為Loss of Setd2 promotes Kras-induced acinar-to-ductal metaplasia and epithelia-mesenchymal transition during pancreatic carcinogenesis的研究工作,證實了SETD2缺失協同KRAS促進胰腺癌發生發展,並闡明了SETD2在胰腺癌起始和轉移兩個階段的不同功能和機製。
胰腺癌被稱為“癌中之王”🚳,惡性程度高、發展和惡化速度快,確診時多為晚期,且至今沒有特別有效的治療方法,從而具有較高的死亡率。因此針對其發病機製的研究極為迫切。90%以上的胰腺癌由外分泌細胞產生,即為胰腺導管腺癌(Pancreatic ductal adenocarcinoma, PDAC)🙆🏽♀️。起始和轉移是PDAC發生發展過程中最重要的兩個階段。炎症和Kras突變均可導致腺泡導管化生(Acinar to Ductal Metaplasia🧿,ADM)🧕,且在Kras持續激活的情況下不可逆進展👨👦。目前ADM被認為是PDAC起始的重要事件。在抑癌基因失調或炎症👃🏼、毒性等刺激的情況下,癌前病變的導管樣細胞會進一步進展為PDAC👨🏻🚒。胰腺腫瘤容易發生遠端轉移,是胰腺癌患者死亡的主要原因。上皮間質化(Epithelial-Mesenchymal Transdifferentiation,EMT)是癌細胞轉移的第一事件。表觀調控異常是惡性腫瘤的重要特征之一😨,近年來已發現胰腺腫瘤中也大量存在表觀修飾異常,但相關機製和功能研究仍比較欠缺🏊🏻♀️。
組蛋白甲基轉移酶SETD2(SET domain-containing protein 2)🍟🤘🏿,是目前已知H3K36me3形成的唯一三甲基化酶👬。目前已知SETD2/H3K36me3主要功能包括參與DNA損傷修復🙅🏿,維持染色質活躍狀態、協助轉錄延伸從而促進基因轉錄水平🔷。血液腫瘤、胃腸道間質瘤👘、結腸癌、神經膠質瘤、乳腺癌等中均發現SETD2的突變和其抑癌功能💾,可見SETD2-H3K36me3是腫瘤中常見的一種抑癌機製,但調控機製具有腫瘤組織的特異性🏄♂️。已有二代測序發現胰腺癌患者同樣攜帶一定比例的SETD2突變,然而其在胰腺腫瘤中的功能和機製尚未明確🌔。
李力副研究員在2014年建立了Setd2條件性基因敲除小鼠模型並在生殖👳🏿♀️🆗、發育和癌症等領域展開廣泛的功能研究(Zuo et al, J Bio Chem, 2018;Wang et al, PLoS Biol, 2018🧝🏻;Xu et al, Nat Genet, 2019)。合作組由此展開進一步研究🛸,結合共用數據庫和臨床樣本🧛🏻♂️🎯,發現SETD2和H3K36me3表達與胰腺癌患者預後顯著負相關。通過構建胰腺特異性敲除Setd2📶,以及聯合Kras突變的小鼠🙆🏽♂️,發現SETD2缺失可以大大促進KRAS誘導的胰腺癌進程。分別對腺泡細胞以及胰腺癌細胞Setd2野生型和Setd2缺失的樣本進行高通量的表達譜和H3K36me3 ChIP聯合分析🦸🏿♀️,發現兩個病理階段中Setd2通過調控不同下遊基因而發揮作用🎒:1)起始階段-調控MYC蛋白的E3泛素連接酶Fbxw7表達👨🏻🚀,影響腺泡細胞穩態,從而促進ADM發生;2)轉移階段🤛:調控Ctnna1粘連蛋白的表達💐,影響E-cadherin穩定性👩🏻🚒🌍,從而促進EMT及轉移 🕍。
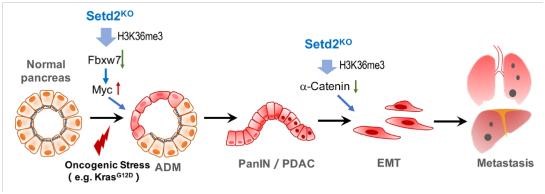
不同病理時期的差異性調節機製,賦予Setd2在復雜疾病中的不同生物學功能🤹🏽♂️,從而更加精準的調控病理過程。本研究首次揭示了SETD2-H3K36me3表觀調控元件協同Kras突變在胰腺癌中的功能與分子機製🙍🏿♀️,深入了我們對其病理機製的認識,為胰腺癌靶向治療提供了新的思路🩸。
牛寧寧副研究員和路平博士為該論文的共同第一作者🍣;薛婧研究員、李力副研究員和孫勇偉主任為該論文的共同通訊作者。
原文鏈接✣: